Läkemedelsbehandling av manifestationer vid systemisk skleros
Rekommendationer från SRF arbetsgrupp för systemisk skleros
Karina Gheorghe (Karolinska universitetssjukhuset, Stockholm)
Johanna Nordström (Universitetssjukhuset Örebro, Örebro)
Cristina Maglio (Sahlgrenska universitetssjukhus, Göteborg)
Dirk Wuttge, ordförande (Skånes universitetssjukhus-Lund, Lund
Sammanfattning
Systemisk skleros är en sällsynt reumatologisk sjukdom som medför betydande lidande för patienterna. Dessa behöver multimodalt teamomhändertagande. Det rekommenderas därför ett nära samarbete med vårdenheter som har team med erfarenhet av patienter med systemisk skleros och berörda organspecialister. Läkemedelsbehandlingen för systemisk skleros baseras på vasodilaterande, immunmodulerande och anti-fibrotiska läkemedel.
Följande behandlingsstrategier rekommenderas för behandling av:
Digitala sår
- Kalciumkanalblockerare eller av fosfodiesterashämmare
- Tillägg av endotelinreceptor-antagonisten bosentan
- Tillägg av prostacyklinanalogen iloprost (dock även tidigare vid hotande sår)
- Överväg botulinumtoxin-Ainjektioner vid refraktära sår
Hudfibros
- Mykofenolat mofetil eller metotrexat,
- Tillägg av rituximab till mykofenolat mofetil eller metotrexat
- Autolog stamcellstransplantation eller cyklofosfamid
- Eventuellt. intravenösa immunoglobuliner
Artrit
- Metotrexat och tillägg av lågdosprednisolon (vid skov)
- Tillägg av rituximab eller tocilizumab eller abatacept
Interstitiell lungsjukdom
- Mykofenolat mofetil eller rituximab; eventuellt cyklofosfamid
- Tillägg av rituximab till mykofenolat mofetil
- Tillägg av nintedanib till mykofenolat mofetil/rituximab
- I utvalda fall tillägg av tozilizumab till mykofenolat mofetil
- Lungtransplantation
Renal kris
- Angiotensin converting enzym hämmare
- Eventuellt plasmaferes eller eculizumab
Gastro-Intestinala manifestationer
- Reflux: omeprazol, esomeprazol eller lansoprazol
- Motilitetsfrämjande: Metoklopramid eller erythromycin
- Obstipation: movicol, linaclotide eller prucalopride
- Diarré: loperamid
- Bakteriell överväxt: rifaximin, ciprofloxacin, metronidazol
- Eventuellt intravenösa immunoglobuliner
- Andra gastrointestinala manifestationer
Innehåll
Bakgrund
Systemisk skleros är en komplex, heterogen och sällsynt reumatologisk sjukdom (incidens 19 per miljon, prevalens 305 per miljon [1]) som medför ett betydande lidande för dessa patienter och stora kostnader för samhället avseende sjukvård, läkemedelsbehandling, arbetsbortfall och inte minst för tidig död [2, 3]. Det rekommenderas därför att patienter med systemisk skleros sköts på eller i nära samarbete med universitetssjukhus eller vårdenheter där det finns vårdteam (reumatologer, sjuksköterskor, fysioterapeuter, arbetsterapeuter, kuratorer) och berörda organspecialister (lungläkare, hjärtläkare, thoraxradiologer, gastroenterologer) med erfarenhet av patienter med denna sjukdom, som kräver multimodalt teamomhändertagande.
Denna skrift fokuserar på läkemedelsbehandling av sjukdomsmanifestationer vid systemisk skleros. Utöver läkemedel, finns ett flertal viktiga aspekter att beakta i behandlingen av patienter med systemisk skleros, som tas upp inom vårdprogrammet och nationella riktlinjer för systemisk skleros men ej i detta dokument. Fördjupning av behandling av pulmonell arteriell hypertension (PAH) har inte tagits upp. Behandling av PAH vid systemisk skleros sköts av hjärt- eller lungspecialister med speciellt intresse för PAH vid universitetssjukhusen, i enlighet med de europeiska rekommendationerna för behandling av pulmonell hypertension från 2022 [4]. Vårdprogrammet för systemisk skleros, som tagits fram av Swedish Scleroderma Study Group (SSSG), och nationella riktlinjer för systemisk skleros ger vägledning om handläggning, utredning och behandling av sjukdomens samtliga manifestationer.
Genomgång av behandlingsrekommendationerna för systemisk skleros har tagit avstamp från EULAR rekommendationer (uppdaterat 2023, litteraturgenomgång tom 230331) [5], 2024 års Guidelines från British Society for Rheumatology (litteraturgenomgång tom 230731) [6], uppdaterade rekommendationer av UK Scleroderma Study group rekommendation för digitala sår 2019 [7], behandlingsalgoritmen av Scleroderma algorythm group (Scleroderma clinical trials consortium och Canadian Scleroderma research group) 2018 [8], franska rekommendationer för behandling av systemisk skleros 2021 [9] samt pubmed genomgång och granskning mellan 2014-01-01 och 2024-11-15. Sjukdomens sällsynthet gör också att antalet behandlingsstudier med fokus på manifestationer av systemisk skleros är begränsade. Övervägande avseende läkemedelskostnader och patientnytta har gjorts i möjligaste mån.

Digitala sår
Digitala sår – bakgrund och rekommendation
Digitala sår på fingrar eller tår är en vanlig manifestation som uppstår huvudsakligen till följd av dålig cirkulation på småkärlsnivå. Kvalificerad sårvård [10, 11] optimal smärtlindring [12, 13] och vid behov antibiotikabehandling beskrivs i vårdprogrammet för systemisk skleros och utgör basen för behandling av digitala sår. Det har varit svårt att påvisa behandlingseffekt av kärlvidgande läkemedel vid digitala sår, eftersom kvalificerad sårvård i många fall leder till sårläkning [14]. Ett flertal nya guidelines [6] och rekommendationer [5, 15-17] samt två systematiska sammanställningar [18, 19] har tagits i beaktande och kompletterats med egna sökningar. Hänsyn har även tagits till synpunkter inom SSSG som påpekat svårigheterna med att förskrivning nifedipinpreparat, som nu endast finns tillgänglig via licens (daterat 241204), och toleransproblem i form av autonom dysfunktion med kalciumkanalblockerare (Ca-antagonister).
För behandling av digitala sår rekommenderas insättning och/eller optimering av Ca-antagonister, såsom nifedipin, felodin eller amlodipin eller fosfodiesterashämare såsom sildenafil eller tadalafil. Vid otillräcklig effekt eller återkommande sår rekommenderas tillägg av endotelinreceptor antagonisten bosentan. Vid otillräcklig effekt eller biverkningar rekommenderas tillägg av intravenösa prostacyklinanalogen iloprost. Valet att rekommendera bosentan före Ilomedin är baserat på förväntat lägre sjukvårdskostnader för behandling med Bosentan jämfört med Ilomedin [20]. Vid behandlingsresistenta sår kan botulinumtoxin-A injektion övervägas.
Sårläkning
Kalciumkanalblockerare (Ca-antagonister)
Ca-antagonister är förstahandsval för att motverka Raynauds fenomen och främja kärlvidgning vid systemisk skleros [5, 6]. Flest studier har genomförts med Ca-antagonisten nifedipin (Adalat). Den högsta tolerabla dosen ska eftersträvas. Ifall att Adalat inte finns tillgänglig kan licenspreparat Nifedipin 10, 20, 30 eller 60 mg rekvireras från utlandet. Patienten får stegvis ökar dygnsdosen i steg om 10 mg var 2 − 3 veckor till upp emot 60 − 80 mg/d. Sårproblematik uppträder dock frekvent trots behandling med nifidepin och en stor australisk prospektiv studie har nyligen indikerat att tilläggsbehandling utöver kalciumanagonister behövs vid fingersår [21]. Två mindre randomiserade kontrollerade studier (RCT) studerade effekten av nifedipin respektive iloprost (Ilomedin) på sjukdomsmanifestationer hos patienter med systemisk skleros. I dessa studier minskade antalet sår efter behandling med båda preparaten jämfört med innan studiestarten. Både nifidepin och iloprost minskade såren i liknande utsträckning. Biverkningar av nifidepin förekommer i form av bensvullnad och reflux. Lyhördhet krävs också avseende manlig potens som kan påverkas negativt av nifedepin. Nifidepin finns nu endast tillgänglig på licens av generiskt preparat. Licensen ansöks om via KLAS (KLAS • E-hälsomyndigheten (ehalsomyndigheten.se)) Separat recept skickas elektroniskt. Ca-antagonisterna felodipin och amlodipin har empiriskt använts som alternativ till nifedipin och kan provas. Studier saknas dock avseende behandling av systemisk skleros relaterade sår eller Raynauds fenomen med felodipin eller amlodipin. Dessa preparat ges i regel en gång dagligen.
Fosfodiesterashämmare
Fosfodiesterashämmare, särskilt sildenafil, rekommenderas nu som andrahandspreparat för kärldilatation av Raynauds fenomen vid systemisk skleros [5, 6]. Sildenafil eller tadalafil används vid behandling av digitala sår. Tre randomiserade placebo-kontrollerade studier som studerade effekten av fosfodiesterashämmare på Raynauds fenomen, visade även tendenser till förbättrad sårläkning i fosfodiesterasgruppen hos de få patienterna med digitala sår [22-24]. Subgruppsanalysen nådde dock inte signifikanta resultat troligen på grund av att studierna hade inkluderat för få patienter. Däremot har en meta-analys av den sammanlagda effekten från dessa tre studier kunnat visa att sårläkningen främjades av behandling med sildenafil [25]. I en senare intention-to-treat studie avseende sildenafils effekt på sårläkning nåddes inte slutmålet, delvis på grund av oväntat hög spontanläkning i placebogruppen [14]. Ett signifikant lägre antal sår sågs dock efter 8 och 12 veckor i sildenafilgruppen. Detta stämmer också med erfarenhet från klinisk praxis inom SSSG gruppen. Man eftersträvar högsta tolerabla dos. Upptrappningen sker med 1 tablett var 3:e dag till en målnivå av 20 − 60 mg 3 gånger dagligen. Man har också visat att fosfodiesterashämmaren tadalafil 20 mg varannan dag, som tilläggsbehandling till kalciumkanalhämmare, främjar sårläkning [24]. Läkemedelspriset varierar stort mellan olika generiska preparat för fosfodiesterashämmare. Förpackningar som ingår i högkostandsskyddet bör väljas i första hand. Vänstersidig hjärtsvikt bör uteslutas med ultraljud av hjärtat före insättning.
Prostacyklinanaloger
Behandling med prostacyklinanalogen iloprost (Ilomedin) har använts länge i Sverige för behandling av svåra Raynauds fenomen och sår. Effekten på sårläkning stöds av placebo-kontrollerade RCT [26] och en Cochraneanalys [27]. Effektstorleken (effect size) för sårläkningen var 23.17 [2.20, 243.52] till fördel för iloprost jämfört med placebo [26, 28]. I en senare metaanalys nådde iloprostbehandlingen inte signifikans för sårläkning (Z = 1.75, p = 0.08) [25] däremot för förebyggande av sår (se nedan). Iloprost har traditionellt ofta givits som infusion om 50 mikrogram intravenöst 3 dagar i följd var 6:e vecka i Sverige. Genomgång av data från Italien och Frankrike indikerar att omgångar av 5 eller fler dagar per månad har givits till patienter med ogynnsamma faktorer såsom anti-Scl-70 antikropp och/eller late skleroderma pattern vid nagelbandsmikroskopi [29, 30] och kan eventuellt förkorta sårläkningstiden [30]. Huvudvärk är vanligt under iloprostbehandling och blodtryckskontroller behöver genomföras frekvent.
Det finns hittills inga studier som jämfört effekten mellan fosfodiesterashämmare och den intravenösa prostaglandinanalogen iloprost. Fosfodiesterashämmare har dock blivit vanligare i praktiken eftersom samhällskostnader kan minskas genom undvikande av intravenös prostaglandinbehandling på sjukvårdsinrättning och därmed minskad sjukfrånvaro. En del patienter är i behov av både kalciumkanalblockerare, fosfodiesterashämmare och intravenös prostaglandinanalog. I dessa fall läggs antingen först fosfodiesterashämmare (exempelvis sildenafil eller taldafil) eller intravenös prostaglandinanalog (iloprost) till Ca-antagonist (exempelvis nifedipin eller felodipin). Vid fortsatt otillräcklig effekt kan alla tre verkningsmekanismerna kombineras.En färsk genomgång av läkemedelsförskrivning för digitala sår inom EUSTAR visar att många patienter endast står på ett läkemedel [31]. Det finns god empiri i Sverige för kombination av flera läkemedel från de 3 läkemedelsgrupperna vid otillräcklig effekt av ett läkemedel. Ca-antagonist tas ej de dagar som ilomedininfusion ges eftersom samtidigt intag av Ca-antagonist kan leda till ökad frekvens av biverkningar under ilomedininfusionen. Det görs inget uppehåll med fosfodiesterashämmare eller endotelinreceptorhämmare.
Två publikationer beskriver sårläkning vid användning av Tofacitinib (n = 12) [32] och Baracitinib (n = 4) [33]. Ingen erfarenhet avseende behandling av fingersår med JAK hämmare finns inom SSSG för närvarande.
Förebyggande av sår
Hos patienter med upprepade sår behöver man alltid utesluta om det finns andra orsaker till såren, framför allt storkärlssjukdom.
Prostacyklinanaloger
Man har i en metaanalys visat att behandling med den intravenösa prostaglandinanalogen iloprost kan minska frekvensen av digitala sår (Z = 2.18, p = 0.03) [25].
Endotelinreceptor-antagonister
Endotelinreceptor-antagonisten bosentan har i två RCT visats kunna förebygga sårrecidiv men hade ingen effekt på sårläkningen [34, 35]. Man kan således överväga att ge bosentan till patienter som fortsätter att få sår trots behandling med kalciumkanalhämmare, fosfodiesterashämmare och prostaglandinanalog. Vänstersidig hjärtsvikt bör uteslutas med ultraljud av hjärtat före insättning. Behandling ges med 62,5 mg x 2 i en månad och ökas sedan till 125 mg x 2. Noggrann kontroll av levertoxicitet är viktig.
Refraktära sår
Botulinumtoxininjektioner
Vid svårläkta sår och/eller svårigheter att tolerera kärlvidgande behandling är injektion av Botuliumtoxin-A vid fingerroten ett alternativ som kan provas. Det vetenskapliga underlaget är dock begränsat och motsägelsefullt, och är sammanfattat i referenser [15], [19]. Flera fallrapporter tyder på gynnsam effekt av botulinumtoxin-A injektioner på sårläkning. Det finns klinisk erfarenhet inom SSSG som tyder på gynnsam effekt av botulinumtoxin-A injektioner på läkning av digitala sår. Behandlingserfarenheter inom SSSG baserar sig på en injektionsteknik som skiljer sig från ovan beskrivna RCTn. Osäkerhet råder avseende vilket som är det mest optimala behandlingssättet avseende injektionsteknik, dos och timing [19].
Risk finns för övergående paralys av muskulatur i handen. Injektioner kan vara smärtsamma men smärtan är endast procedurrelaterad. Behandlingen ska endast utföras av personal vid specialistenhet som är van vid att ge injektioner med botulinumtoxin till patienter med systemisk skleros.
Kärlvidgande läkemedel och graviditet
Graviditet ska inte påbörjas vid behandling med bosentan.Det är därför viktigt med information om noggrannhet med preventivmedel. Vid behov av kärlvidgande läkemedel under graviditet bör kontakt tas med specialistmödravården för diskussion.
Hurfibros
Hud – bakgrund och rekommendation
Hudfibros vid systemisk skleros av diffus kutan typ kan progrediera snabbt och vara mycket handikappande. Snabbt progredierande hudengagemang i början av sjukdomen är associerad med ökad mortalitet och engagemang av inre organ, såsom hjärta och lungor [36]. Sjukdomens naturliga förlopp med utveckling av hudatrofi och sedan minskning av hudstramheten gör det svårt att tolka resultat av interventionsstudier. Trots det naturliga förloppet av hudsklerosen, är det viktigt att behandlingen initieras tidigt i de fall det finns indikation för att minska sena skador och funktionsnedsättning såsom kontrakturer.
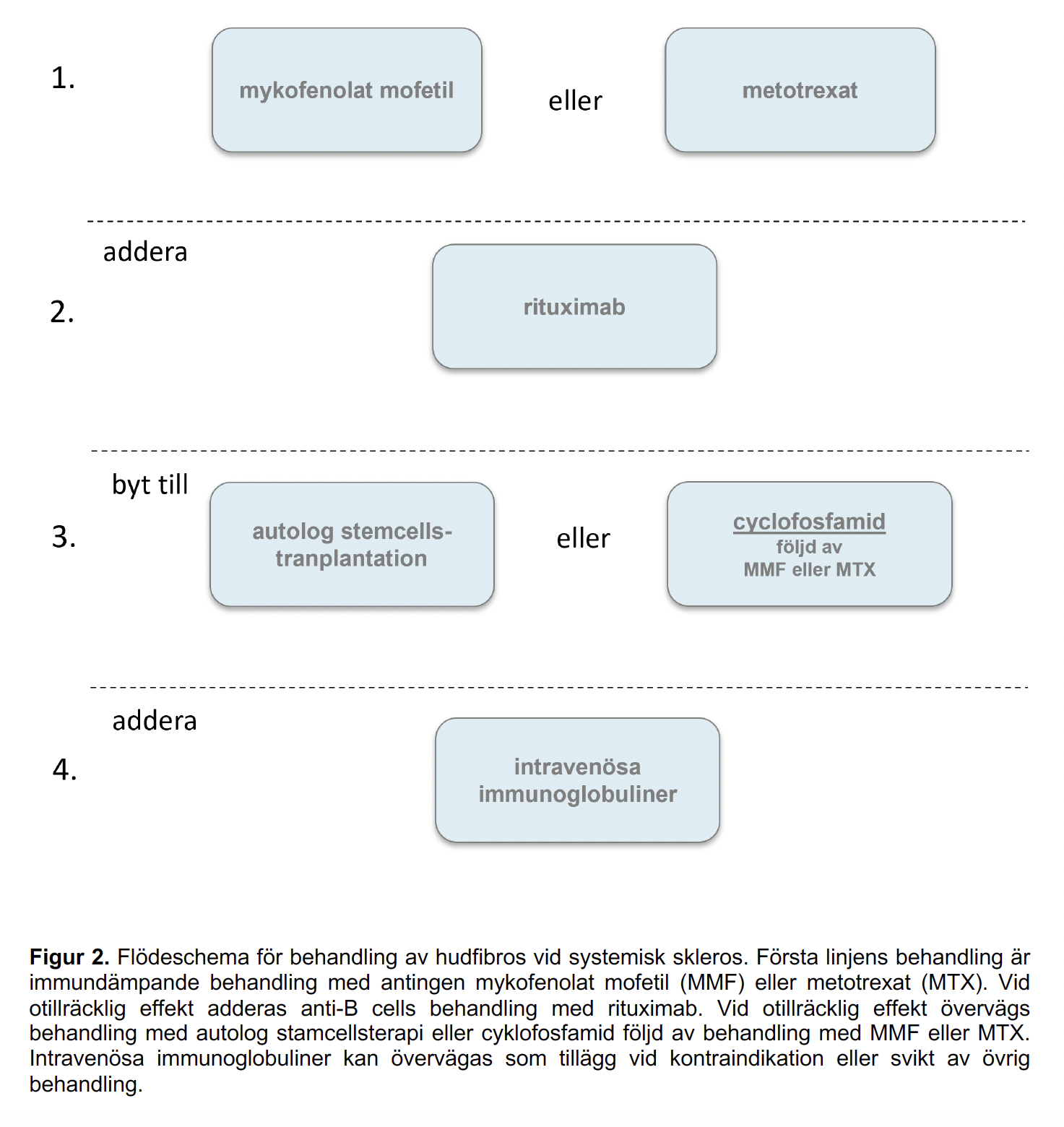
För behandling av hudfibros rekommenderas mykofenolat mofetil (MMF) eller metotrexat (MTX). Vid snabbt progredierande hudfibros rekommenderas tillägg av rituximab. Vid otillräcklig effekt hos patienter med snabbt progredierande hudengagemang utan allvarligt inre organengagemang kanautolog stamcellstransplantation (ASCT) övervägs. Behandlingen ska övervägas tidigt i sjukdomsförloppet (högst 4-5 år sedan sjukdomdebut), innan svåra inre organengagemang tillkommer. Även cyklofosfamid intravenöst kan övervägas vid snabbt progredierande sjukdom. Intravenösa immunoglobuliner (IvIG) har främst använts som tilläggsbehandling hos patienter med systemisk skleros med refraktär sjukdom. Kortisonparande effekt har observerats. IvIG kan således övervägas som tillägg till patienter som inte svarat på behandling med MMF eller MTX där patienterna ej är aktuella för behandling med rituximab, ASCT eller cyklofosfamid.
Konventionella DMARDs
Immunomodulerande terapier har sedan länge använts i klinisk praxis, och det finns stöd för det av varierande evidensgrad. T.ex. rapporterade en liten (n=29) RCT redan 1996 minskad total skin score hos patienter som behandlades med MTX (15-25 mg/v) jämfört med patienter som fick placebo [37]. Det finns ett antal retrospektiva undersökningar som stödjer användning av andra immunsuppressiva läkemedel som tex MMF för behandling av hudskleros [38, 39]. Dessutom visar post-hoc-analyser från de randomiserade kliniska studierna Scleroderma Lung Study I och II förbättrade modifierade Rodnan-skin scores (mRSS) för både MMF och cyklofosfamid efter 24 månader [40]. Cyklofosfamid ger en liknande förbättring i mRSS som MMF, men är förknippad med en betydande risk för biverkningar, särskilt leukopeni [41]. På grund av biverkningsprofilen rekommenderas därför cyklofosfamid inte som förstahandsbehandling.
Ett observandum är att en stor europeisk observationell studie (n=326) inte kunde påvisa någon signifikant skillnad beträffande hudengagemang hos patienter med tidig systemisk skleros av diffus kutan typ i någon av behandlingsarm (MTX, MMF, cyklofosfamid, ”ingen behandling”) 24 månader efter behandlingens start [42]. Trots detta rekommenderas immunosuppressiv behandling för patienter med progredierande hudskleros eftersom immunosuppression visats bidra till minskad mortalitet [43, 44].
Det kan krävas mångårig behandling med DMARDs avseende hudengagemang. Det har visats att hudprogress kan ske efter avslutad behandling (eller minskad dos) med MMF [45, 46].
Biologiska DMARDs
Behandling med rituximab skall övervägas vid progredierande hudfibros. I en RCT har det visats att mRss hos patienter som behandlades med rituximab (två 1g doser med 2 veckors mellanrum) minskade 24 veckor efter interventionen till skillnad från patienter som fick placebo, där mRss ökade [47]. Effekt ses även i förlängningsstudien efter 48 veckor [48]. Skillnaden var signifikant och kliniskt relevant. Denna studie är dock gjord enbart på japansk population, vilket gör att resultat bör tolkas med viss försiktighet. Till stöd för rituximab behandling finns även observationella studier [49, 50] och en multicenter open-label okontrollerad studie [51]
Autolog stamcellstransplantation
ASCT kan övervägas vid snabbt progredierande hudfibros trots aktiv behandling.ASCT har haft mycket bra effekt på bl.a. mRss i flera RCTs [52, 53] och systemisk skleros av diffus kutan typ med snabbt progredierande hudengagemang är indikation för ASCT i bl.a. USA [54]. Trots att den initiala behandlingsrelaterade mortaliteten i ASCT patientgrupperna var signifikant högre jämfört med patienter som behandlats med cyklofosfamid, bör ASCT övervägas för patienter med snabbt progredierande hudengagemang som har hög risk för svårt engagemang av andra organ [55]. Behandling med ASCT utförs enbart vid två centra i Sverige (Karolinska universitetssjukhuset och Skånes universitetssjukhus) inom ramen av högspecialiserad vård. Patienter som är möjliga kandidater för ASCT skall remitteras dit för bedömning. Erfarenhet av stamcellstransplantation för patienter med systemisk skleros är begränsad i Sverige.
Intravenösa Immunoglobuliner
IvIG kan övervägas som tilläggsbehandling hos patienter med systemisk skleros med refraktär sjukdom. Dock är evidensen för behandling med IvIG på hudindikation begränsad.Litteraturen avseende IvIG behandling vid systemisk skleros har sammanställts i två systematiska litteraturgenomgångar [56-58]. Avseende hudmanifestationer inkluderades 11 studier med sammanlagt 344 patienter. Sammanställningen visar genomgående en förbättring av mRSS efter upprepade behandlingar med IVIG. 2g/kg/månad har givits främst mellan 6 och 12 månader upp till drygt 2 år. Därutöver finns det ett flertal fallbeskrivningar som beskriver gynnsam effekt på mRss vid tillägg av IvIG till sviktande standardbehandling. Genomgången påpekar risken av bias särskilt avseende patienturval och ”confounding” eftersom de flesta studierna är av retrospektiv karaktär och endast en RCT är genomförd. Det rekommenderas att IvIG ges totalt 2g/kg kroppsvikt per månad med administration á 0,4g/kg kroppsvikt per dag i 5 dagar. Upprepade behandlingar har oftast visat effekt på mRss antingen som stabilisering eller förbättring av hudfibrosen. En kortisonsparande effekt har observerats.
JAK-hämmare
Evidensen för användning av JAK-hämmare vid behandling av hudsymtom vid systemisk skleros är begränsad. En meta-analys vilken inkluderade 9 studier (59 patienter totalt, där 47 fick tofacitinib och 12 baricitinib har visat förbättring i mRSS score (-5 till -25 poäng från baseline, median -10) [59].
Artrit
Artrit – bakgrund och rekommendation
Ledengagemang är vanligt förekommande vid systemisk skleros, ofta i form av artralgier och stelhet. Ultraljudsundersökning kan bekräfta förekomst av synovit eller tenosynovit i upp till 50%, respektive 30% av fallen. I avsaknad av kliniska prövningar med immunomodulerande behandling mot artriter hos systemisk skleros patienter, utgörs behandlingsrekom-mendationerna av expertkonsensus [8] och studier med lågt antal patienter, oftast okontrollerade studier [60]. Fallrapporter, fallserier eller små retrospektiva fall-kontrollstudier dokumenterar användning av klassiska DMARD eller biologisk behandling.
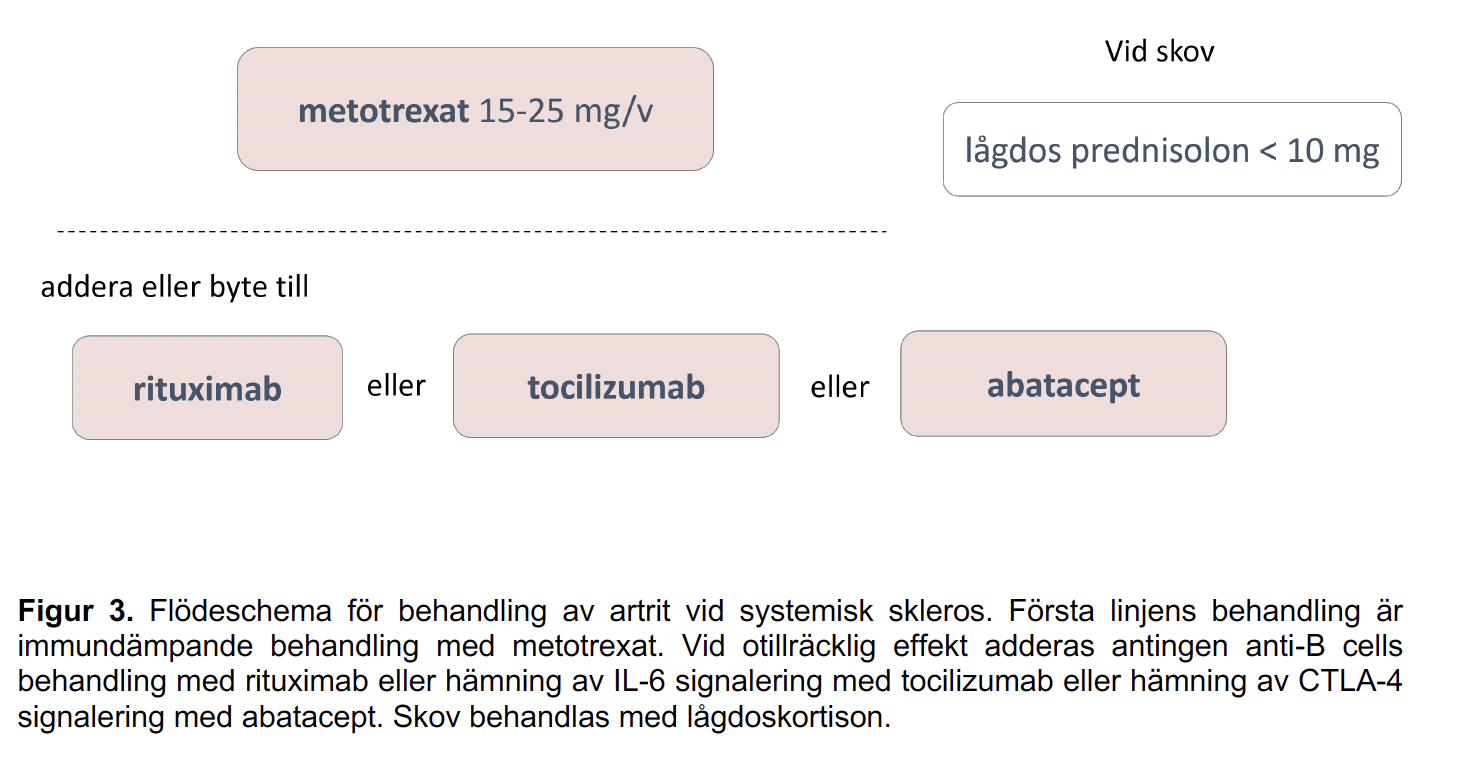
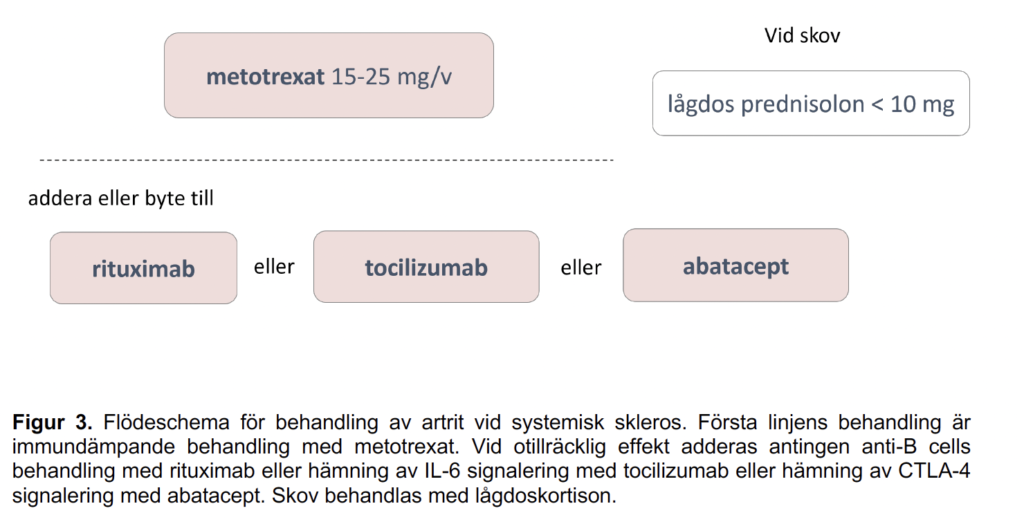
Rekommendationen för behandling av artrit hos patienter med systemisk skleros är i första hand metotrexat(MTX), lågdos prednisolonkan övervägas vid skov. Nästa steg i behandlingstrappan utgörs av rituximab,tocilizumab och abatacept.
DMARD
Den generella expertrekommendationen är att behandlingen initieras i första hand med MTX, i analogi med reumatoid artrit [5]. Lågdos kortison motsvarande prednisolon <10 mg/dag används med försiktighet på grund av risken för renal kris vid högre doser hos denna patientgrupp. Det saknas underlag för hur länge varje behandlingssteg i trappan bör fortgå före utvärdering. Handläggningen bör individualiseras beroende på svårigheten av patientens ledsymtom och andra organmanifestationer. Det finns även fallrapporter som beskriver effekt på artritsymptomen för leflunomid[9, 61] och plaquenil. Det finns empirisk erfarenhet inom SSSG att behandla artriter med azathioprin.
Biologiska DMARD
Tocilizumab och abatacept har visats minska antalet ömma och svullna leder, stelhet och smärta, i en liten observationell studie av systemisk skleros patienter med artrit (15, respektive 11 patienter behandlade med tocilizumab, respektive abatacept) [62]. Ytterligare ett par fallserier/-rapporter har dokumenterat effekten av tocilizumab [63, 64]. Effekten av abatacept på antal svullna och ömma leder har undersökts som sekundärt utfallsmått i en dubbelblind randomiserad placebo-kontrollerad fas II studie med 88 patienter. Ingen skillnad har kunnat påvisas efter 12 månaders behandling mellan abatacept- och placebogruppen [65]. Rituximab har visat sig reducera antal svullna och ömma leder efter 6 månader i en liten open label okontrollerad studie med lågt antal patienter [66].
JAK-hämmare
I en open label randomiserad kontrollerad prövning med totalt 66 patienter, har tofacitinib undersökts avseende effekt på hud samt muskuloskeletalt engagemang vid 52 veckors behandling och jämförts med metotrexat (veckodos 10 mg). Effekt på både modifierad mRss samt muskuloskeletalt ultraljudsscore har visat fördel för tofacitinib jämfört med MTX [32]. Fallrapporter och fallserier för terapi med JAK-hämmare vid systemisk skleros har sammanställts i en systematisk översikt där tofacitinib, och i mindre utsträckning baricitinib, har använts för patienter med systemisk skleros där behandlingsindikationen har varit hudskleros och mindre frekvent ledengagemang. De få patienter som fått terapi med tofacitinib eller baricitinib har alla rapporterat effekt på ledmanifestationer, i några fall med reduktion av DAS28 [59, 67].
I en open-label pilotstudie på begränsat antal patienter, har IvIG efter 6 månaders behandling rapporterat signifikant förbättring av svullna och ömma leder, tillsammans med minskning av mRss [68].
Interstitiell lungsjukdom
Interstitiell lungsjukdom – bakgrund och rekommendation
Behandling ska övervägas för alla patienter med systemisk skleros och lungengagemang. Bedömningen baseras på en kombination av ökad fibros på high resolution CT (HRCT), minskning av lungfunktion mätt med (forcerad) vitalkapacitet (FVC eller VC) och/eller diffusionskapacitet och/eller försämring av subjektiva symptom och ansträngningskapacitet [69]. Man ska även ta hänsyn till alla riskfaktorer för progressiv sjukdom, såsom exempelvis förekomst av Scl-70 antikroppar. Behandlingsindikationen stärks vid progredierande sjukdom och/eller om det förekommer riskfaktorer.
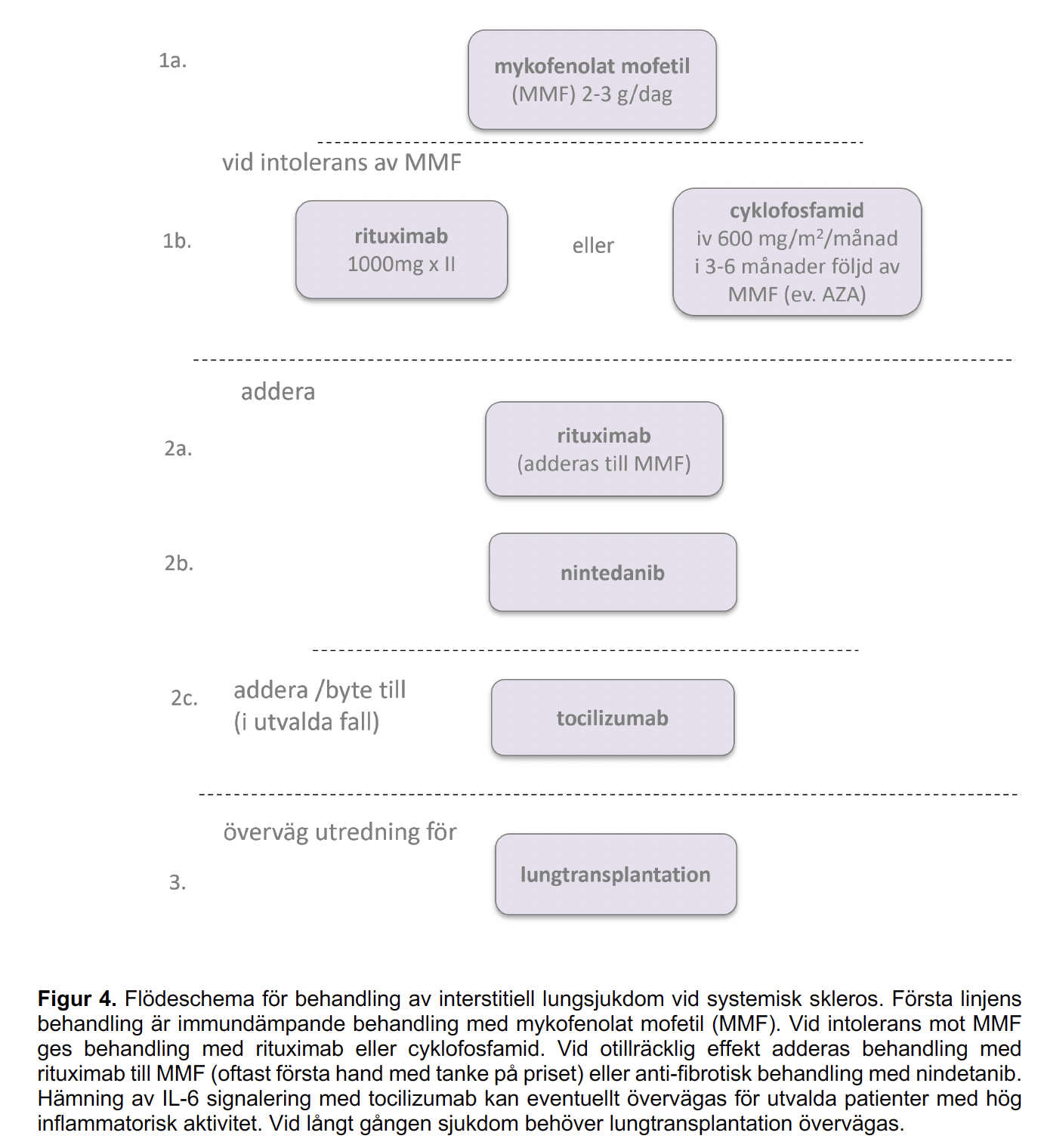
I nuläget rekommenderas i första hand behandling med mykofenolat mofetil (MMF). Utifrån alltmer övertygande data gällande rituximabkan även detta övervägas som förstahandsbehandling, vid intolerans mot MMF. Detta stöds av tidigare klinisk erfarenhet, god kännedom om läkemedlet samt den effekt det kan ha även vid andra manifestationer av systemisk skleros. Eventuellt kan initial behandling med cyklofosfamid övervägas i vissa fall tex. när MMF ej tolererats. Detta ska då följas av behandling med, i första hand MMF förutsatt att patienten tolererar detta (3g/dygn, eller högsta tolererade dosen över 1,5g/dygn) och i andra hand azathioprin (2 − 2,5mg/kg/dygn) [70]. Vid användning av cyklofosfamid rekommenderas att ge intravenösa pulsar (600mg/m2 var 4:e vecka).
Vid progress trots ovanstående alternativ ska kombinationsbehandling med MMF och rituximab respektive MMF och nintedanibövervägas. Vid behandlingsbeslut ska hänsyn tas till övriga sjukdomsmanifestationer. Om patienten exempelvis har andra manifestationer i behov av immunsuppressiv behandling bör rituximab väljas i första hand. I särskilda fall, hos patienter med hög inflammatorisk aktivitet, kan behandling med tocilizumabprovas. Vid svårare sjukdom, med snabb progress som inte svarar på behandling kan lungtransplantation eller autolog stamcellstransplantation övervägas. Hos patienter som inte svarat på eller inte tolererat ovanstående läkemedelsbehandling kan eventuellt JAK-hämmare vara ett behandlingsalternativ. Bland JAK-hämmarna finns mest evidens för tofacitinib.
Mykofenolat mofetil
MMF används i första hand vid behandling av interstitiell lungsjukdom (ILD) vid systemisk skleros. Till stöd för detta finns fallrapporter, klinisk erfarenhet samt flera studier, varav bland annat en randomiserad kontrollerad studie (RCT) och två retrospektiva studier [71-73] samt expertkonsensus [74]. I en RCT, Scleroderma lung study 2, jämfördes behandling med MMF 3g/dygn under 24 månader med peroralt cyklofosfamid 2mg/kg/dygn under 12 månader följt av placebo under 12 månader [41]. Vid uppföljning efter 24 månader sågs ingen signifikant skillnad i FVC mellan grupperna. Det sågs däremot en signifikant förbättring i FVC i båda grupperna. Som sekundära utfall, utan skillnad mellan behandlingsgrupperna, påvisades även förbättring i självrapporterad dyspné, hudtjocklek och utbredning av ILD på HRCT. Biverkningsmässigt tolererades MMF bättre än cyklofosfamid. Detta gällde främst leukopeni och trombocytopeni.
Cyklofosfamid
Det finns en lång beprövad erfarenhet där cyklofosfamid, både peroralt och intravenöst, använts vid behandling av ILD. Till stöd för behandling finns även expertkonsensus [74]. I en RCT, Scleroderma lung study 1, har man kunnat visa att enbart terapi med peroralt cyklofosfamid gav marginellt förbättrad lungfunktion jämfört med placebo [75, 76]. Efter 12 månader utsattes behandlingen. Vid uppföljning 12 månader efter avslutad cyklofosfamidbehandling hade patienterna åter försämrats och lungfunktionen hade jämförbara värden med före behandlingsstart. Det kvarstod emellertid förbättring i patientrapporterad dyspné.
I Scleroderma lung study 2 [41], se ovan, sågs ingen skillnad i FVC mellan behandling med MMF och cyklofosfamid. Däremot sågs inom respektive behandlingsgrupp en signifikant förbättring i FVC.
Rituximab
Ett möjligt alternativ är rituximab. Det finns flera öppna jämförande studier och observationsstudier som talar för viss effekt avseende FVC [49-51, 77]. I en öppen randomiserad studie jämfördes rituximab med cyklofosfamid. Efter 6 månader sågs signifikant förbättring i FVC hos de patienter som erhöll rituximab men inte hos dem som fick cyklofosfamid [78]. I en RCT jämfördes rituximab med placebo, med skillnad i mRSS efter 24 veckor som primärt utfallsmått [47]. Studien kunde efter 24 veckor visa signifikant skillnad mellan grupperna avseende såväl mRSS som FVC till fördel för rituximab. Studiedeltagarna var enbart av japanskt ursprung. Ingen liknande studie finns för andra populationer. I en dubbelblind, randomiserad, fas II studie, RECITAL har effekten av rituximab jämförts med cyklofosfamid intravenöst hos 101 patienter med bindvävssjukdom-associerad ILD, varav cirka 37% hade diagnosen systemisk skleros. Efter 24 veckor, har förbättringar i lungfunktion (FVC) och patientrapporterade mått visat effekt för både rituximab- och cyklofosfamidterapi. Ingen fördel i effektmåtten har kunnat visats för rituximab, dock har färre biverkningar visats jämfört med cyklofosfamid [79].
Det finns flera systematiska översikter [80-82] där resultaten sammantaget talar för en stabilisering och möjligen även en förbättring av lungfunktionen. Flera av studierna är dock retrospektiva och i prospektiva studier saknas ofta jämförelse mot placebo. I en randomiserad, dubbelblind studie hos 122 patienter med ILD associerat till bindvävssjukdom eller idiopatisk interstitiell pneumoni och NSIP (non specific interstitial pneumonia) mönster har behandling med enbart MMF och placebo jämförts med kombinationsbehandling med MMF och rituximab [83]. 19% av patienterna hade systemisk skleros. Efter 6 månader sågs signifikant skillnad mellan grupperna avseende förändring i FVC från baseline, till fördel för kombinationsbehandling. Fler infektioner sågs i gruppen som fick kombinationsbehandling. En annan studie har retrospektivt jämfört utfallsmått för kombinationen MMF och rituximab med autolog stamcellstransplantation [84]. I studien ingick 21 patienter med systemisk skleros i gruppen med kombinationsbehandling och 16 i gruppen som erhöll autolog stamcellstransplantation. I båda grupperna sågs vid varje mättillfälle upp till efter 24 månader en signifikant och jämförbar förbättring i FVC-värden. En bättre säkerhetsprofil förelåg i gruppen med kombinationsbehandling.
Nintedanib
Antifibrotisk behandling med tyrosinkinashämmaren nintedanib kan också övervägas som behandling. Detta kan bli aktuell som tillägg till annan immunsupressiv behandling för att minska progress av ILD och lungfunktionsförlust. ILD associerad till systemisk skleros finns som indikation för nintedanib. Detta baseras främst på en RCT, SENSCIS-studien, där 576 patienter erhåll antingen nintedanib eller placebo [85]. Efter 52 veckor sågs mindre försämring av FVC i gruppen som erhöll nintedanib jämfört med placebo. 48,4% av patienterna stod även på MMF vid baslinjen. Subanalyser tyder på mest fördelaktigt resultat av kombinationen nintedanib och MMF. Det sågs ingen skillnad, avseende försämring i FVC, mellan de patienter som behandlades med enbart nintedanib och de som endast stod på MMF. Vid en annan RCT jämfördes nintedanib med placebo hos patienter med progressiv fibrotiserande ILD [86]. Försämring i FVC var signifikant lägre i nintedanibgruppen jämfört med placebo efter 52 veckor.
Även om behandling med nintedanib är godkänd för ILD vid systemisk skleros, finns begränsade kunskaper, särskilt utifrån andra organmanifestationer vid systemisk skleros. Insättning bör därför ske i samråd med reumatolog på universitetssjukhus samt i diskussion med lungläkare. Det har framkommit farhågor kring GI-problematik då detta är en vanlig biverkan av nintedanib [87]. I SENSCIS-studien var det närmare 50% i nintedanibgruppen som fick dosreducera eller göra behandlingsuppehåll pga biverkningar, främst diarré [88]. Dosreduktion ledde dock inte till sämre behandlingseffekt. Biverkningar ledde till permanent avslut av behandling hos 16% i nintedanibgruppen resp 8,7% i placebogruppen. SENCIS-ON-studien visar liknande biverkningsprofil efter ytterligare ett års behandling [89]. Det finns även en osäkerhet kring läkning av sår, där patienter med mer extensiv sårproblematik inte inkluderats i SENSCIS-studien. Inte heller patienter med PAH inkluderades i denna.
Tocilizumab
Behandling med tocilizumab kan övervägas till patienter med inflammatorisk aktivitet. I en randomiserad studie [90]. analyserades lungfunktion som sekundärt utfallsmått. I denna studie nåddes inte det primära utfallet som var signifikant skillnad i mRss mellan tocilizumab och placebo efter 48 veckors behandling. I gruppen som behandlades med tocilizumab var det en signifikant lägre andel som försämrades i FVC jämfört med gruppen som erhöll placebo. I inklusionskriterierna för denna studie ingick inflammatorisk aktivitet i form av förhöjd SR, CRP eller TPK. Även i en fas 2 studie med mRss som primärt utfallsmått, som inte uppnåtts, kunde man visa på viss effekt avseende lungfunktion [91, 92].
I en observationell europeisk multicenterregisterstudie, har man inte kunnat notera någon statistisk signifikant skillnad efter 12 månaders behandling hos patienter med tocilizumab jämfört med standardterapi vad gäller förbättring av hudfibros eller lungfunktion [93].
JAK-hämmare
För närvarande finns inga randomiserade kontrollerade studier gällande behandling med JAK-hämmare vid ILD vid systemisk skleros. Det finns flera mindre kliniska studier och fallrapporter som indikerar stabilisering eller förbättring av lungfunktion. Mest studerat är tofacitinib. [59, 94, 95]
Stamcellstransplantation och lungtransplantation
Patienter med snabbt progredierande lungsjukdom eller patienter som inte svarar på sedvanlig behandling enligt ovan kan bli aktuella för behandling med autolog stamcellstransplantation [52, 53] eller lungtransplantation [96-98] efter noggrant övervägande avseende riskfaktorer för behandlingsrelaterade komplikationer. Beslut om dessa åtgärder ska fattas av reumatolog vid universitetssjukhus.
Renal kris
Renal kris – bakgrund och rekommendation
Njurpåverkan vid systemisk skleros kan utgöras av olika manifestationer, varav den mest studerade och allvarliga komplikationen är renal kris. I detta dokument kommer vi att fokusera på behandlingsrekommendation avseende scleroderma renal kris. Renal kris är en sällsynt komplikation vid systemisk skleros som oftast uppstår tidigt i sjukdomsförloppet och är vanligare vid förekomst av vissa sjukdomsmarkörer (RNA-polymeras III och Scl-70 autoantikroppspositivitet och/ eller diffus systemisk skleros) [99, 100]. Den är associerad till ökad mortalitet och morbiditet i form av (potentiellt terminal) njursvikt om behandlingen fördröjs.
Angiotensin converting enzyme hämmare
Angiotensin converting enzyme (ACE)-hämmare är första linjens behandling med ett målblodtryck <140/90 inom 72 timmar [101]. Kortverkande ACE-hämmare (captopril 12,5 mg) rekommenderas initialt för snabb upptitrering av dos och kontroll av BT [99]. Ökat kreatinin, vilket förväntas med ACE hämmare, ska ej föranleda reducerad dos. När blodtrycksmålet har uppnåtts och blodtrycket stabiliserats, kan man byta till långverkande ACE-hämmare [99, 101] som bibehålls.
Om blodtrycket ej är tillräckligt reglerat med ACE-hämmare, föreslås tillägg av calciumflödeshämmare. Diuretikum eller alfablockerare kan adderas till behandlingen om blodtrycksmålet ej uppnås [101].
Vid normotensiv renal kris, ges ACE hämmare av kort- eller intermediär halveringstid (ramipril) och blodtrycket föreslås hållas ≥100-110 mm Hg systoliskt för att undvika ischemi och akut tubulär nekros [9].
Patienter som startar dialys på grund av njursvikt i samband med renal kris kan förbättras i njurfunktionen upp till 2 år efter dialysstart varför njurtransplantation bör avvaktas. Upp till 50% av patienter med dialys kan avsluta denna behandling [101].
Behandling med ACE-hämmare före utveckling av skleroderma renal kris är förknippad med högre förekomst av denna komplikation varför förebyggande behandling inte rekommenderas [5, 102].
Plasmaferes
Det finns endast fallrapporter eller retrospektiva studier för användning av plasmaferes vid renal kris. I en retrospektiv studie från 2012, har man noterat att patienter med renal kris som genomgått plasmaferes hade en lägre förekomst av end-stage renal disease (20% jämfört med 55%, total antal patienter 20 varav hälften fick plasmaferes) och lägre dödlighet vid 1 och 5 år [103]. Rekommendationen för användning av plasmaferes enligt The American Society of Apheresis är för patienter med tecken till mikroangiopatisk hemolytisk anemi eller som är intoleranta mot ACE-hämmare [101, 104].
Eculizumab
Det finns begränsade data för behandling med eculizumab (C5 komplementhämmare) vid renal kris, i form av några få fallrapporter samt en fallserie med 6 patientfall. I alla fallbeskrivningar förekommer hemolytisk anemi, komplementkonsumption och refraktär sjukdom som ej svarat på sedvanlig behandling [105]. Hematologisk förbättring och i vissa fall även förbättring av njurfunktionen har rapporterats efter insatt eculizumab behandling [106]. Behandlingen kan vara aktuell efter noggrann övervägning hos patienter som inte svarar på sedvanlig behandling, inte minst med anledning av infektionsrisken och kostnaden.
Gastro-Intestinala manifestationer
Engagemang av mag-tarmkanalen förekommer i stor utsträckning vid systemisk skleros och är det organ som är mest frekvent påverkat under sjukdomsförloppet. Alla delar av mag-tarmkanalen kan involveras i sjukdomsprocessen och ge symptom som har stor påverkan på patientens livskvalitet, psykosocial funktion samt morbiditet och mortalitet.
Behandlingsrekommendationerna består i de flesta fall av symptomatisk terapi pga avsaknad av prövningsstudier med specifika utfallsmått för gastro-intestinala manifestationer av sjukdomen. Sådana studier är svåra att genomföra till följd av sjukdomens varierande naturalförlopp och heterogenitet.
För behandling av reflux och dysfagi rekommenderas i första hand protonpumpshämmare omeprazol,esomeprazol eller lansoprazol. För refraktära fall, kan tillägg av magslemhinneskyddande alginsyra eller/och av histaminreceptorantagonist famotidin(preparaten i klassen som finns tillgänglig i Sverige) behövas.
Motilitetsfrämjande metoclopramid rekommenderas i första hand, och erytromycin i andra hand, för dysmotilitet i magsäcken. För främjandet av motiliteten i tjocktarmen rekommenderas i första hand laxantia<, och i andra hand linaclotide eller prucaloprid, i samråd med gastro-enterolog. För bakteriell överväxt i tunntarmen finns stöd för behandling med alternerande anitbiotikakurer, i första hand rifaximin, i andra hand metronidazol, ciprofloxacineller kombination av antibiotika.
Protonpumpshämmare (PPI)
Protonpumpshämmare (PPI) är första linjens behandling för reflux och dysfagi vid systemisk skleros [5, 6]. Lämplig dos och längd av terapi har inte studerats vid systemisk skleros, men det finns data som indikerar att högre doser (upp till 80 mg omeprazol) kan ge signifikant förbättring av symptom och läkning av esofagit. Både lansoprazol (30 mg dagligen) och rabeprazol (10 mg dagligen) har undersökts i randomiserade kontrollerade studier vid systemisk skleros med symptomatisk mildring av refluxsymptom vid 6 månader, respektive 4 veckor[107, 108]. I analogi med svår refluxsjukdom i den allmänna befolkningen, rekommenderar det amerikanska gastroenterologiska sällskapet (American Gastroenterolgical Association) två-dos förfarande vid kvarstående refluxsymptom [107].
Histamin receptor 2 (H2) antagonist
Histamin receptor 2 (H2) antagonister är mindre effektiva för refluxbehandling än PPI [107] och det råder oenighet avseende deras plats i behandlingsarsenalen för reflux och dysfagi vid systemisk skleros. Tillägg av ranitidin till omeprazol har inte visat bättre effekt än monoterapi omeprazol i en cross-over randomiserad prövning [107], varför rekommendation för användning av H2 hämmare reserveras till refraktära fall [6, 109].
I en randomiserad kontrollerad studie över 4 veckor har barriärmedletalginsyra som tilläggsbehandling till omeprazol 20 mg två gånger dagligen visat liknande förbättring av reflux-relaterade symptom som prokinetiska läkemedlet domperidon. Det finns inga rekommendationer om magslemhinneskyddande läkemedel i de nya EULAR riktlinjerna. Hos patienter med kvarstående refluxsymptom trots PPI behandling kan emellertid barriärmedel som alginsyra (Gaviscon,Gallieve) läggas till för symptomkontroll.
Motilitetsfrämjande och motilitetshämmande
Dysmotilitet i esofagus kan också upplevas som dysfagi, heshet, nattlig hosta, medan det i magsäcken och tarmen kan ta sig uttryck i form av illamående, tidig mättnadskänsla, uppblåsthet, buksmärta, obstipation eller diarré. Det finns prokinetiska agens som påverkar olika delar av den gastro-intestinala kanalen och har varierande effektivitet. Deras användning begränsas därför till patienter med kvarstående symptom trots livsstilsförändringar och maximal refluxbehandling.
Metoklopramid förbättrar magsäckens motilitet och minskar illamående; den rekommenderas för kortvarig behandling vid gastropares i samband med måltiderna. Rekommendationen är baserat på studier av metoklopramid i den allmänna befolkningen, och mindre på studier av patienter med systemisk skleros [9, 107]. Även erythromycin påverkar magsäckens motilitet positivt och kan provas i flytande beredning ([110], nationella SSc-riktlinjer).
Opstipation är det mest frekventa symptomet vid tjocktarmsdysmotilitet, men även buksmärta och tömningssvårigheter förekommer vid tjocktarmsdysmotilitet. Det rekommenderas laxantia (fiber, osmotiskt aktiva eller peristaltikstimulerande) för behandling av obstipation. Inga studier finns dock som har undersökt laxantia vid just systemisk skleros, varför rekommendationerna liknar dem som finns för den allmänna befolkningen. Osmotiska laxantia, såsom Movicol, är förstahandsvalet [6, 107]. Vid systemisk skleros har sekretionsstimulerande linaclotide [111] och motorikstimulerande prucaloprid[112] undersökts i en retrospektiv studie på 31 patienter, respektive en placebokontrollerad cross-over studie på 29 patienter. Båda läkemedel visade effekt vid refraktära nedre GI symptom.
Några få studier med lågt antal patienter har undersökt effekten av oktreotid, en somatostatin analog, vid SSc och visat förbättring av intestinal peristaltik och buksymptom [113, 114]. Behandlingen kan erbjudas utvalda patienter med kronisk intestinal pseudo-obstruktion efter samråd med gastroenterolog [9].
Loperamid rekommenderas för symptomatisk behandling av diarré enligt expertopinion [6], men några studier vid SSc finns det inte.
Antibiotika mot bakteriell överväxt
Enteral dysmotilitet kan ge upphov till bakteriell överväxt i tunntarmen med kronisk diarré som följd. Alternerande antibiotika, som ges 1-2 veckor per månad, rekommenderas enligt expertkonsensus ([6, 9] + nationella SSc-riktlinjer), baserat på små open-label eller retrospektiva studier [107]. I en open-label studie av 30 patienter har rifaximinförbättrat GI symptom relaterade till bakteriell överväxt [115]. Detta stödjs också av en meta-analys [116] som visat överlägsenhet av rifaximin jämfört med annan antibiotikaregim. Rifaximin, som agerar lokalt i tarmens lumen, rekommenderas i första hand i dos 550 mg x3, följd av ciprofloxacin 250 mg x2, metronidazol eller kombinationer av antiobiotika.
Intravenöst immunglobulin
Intravenöst immunglobulin (IvIg) har undersökts i några små fallserier hos patienter med SSc och myositoverlap eller SSc med positiva autoantikroppar mot muscarin 3 receptor. Man har noterat att IvIg förbättrade refluxsymptom, UCLA GIT 2.0 score (som utvärderar flera domäner av GI engagemang vid SSc) eller esofagus dysmotilitet. En observationell retrospektiv multicenterstudie har utvärderat effekten av IvIg hos 27 patienter med systemisk skleros. Man har noterat att det är framför allt analinkontinensdomänen vid förbättrad total UCLA GIT score som skiljer sig signifikant efter behandlingen vid gastro-intestinalt engagemang med IvIG[117].
Andra gastrointestinala manifestationer
Gastric antral vascular ectasia (GAVE) förekommer hos patienter med systemisk skleros och uttrycker sig som blödning från dilaterade små venuler eller kapillärer i magsäcken (mer sällan i tarmen). Det finns några fallrapporter där intravenös cyklofosfamid har minskat behov av blodtransfusion och i något fall även minskat antal ektasier vid kontrollendoskopin [118]. Behandlingen innefattar för övrigt behov av argonplasmakoagulation, oftast upprepade gånger, tills lesionerna är läkta.
Analinkontinens är en mycket handikappande komplikation med stor påverkan av patientens livskalitet. Läkemedelsstudier finns det inte genomförda. För behandling av analinkontinens får vi därför hänvisa till SSSGs vårdprogram, nationella riktlinjer för systemisk skleros samt översiktsartikelar [119].
Flödescheman
Figur 1 - Flödeschema för behandling av digitala sår vid systemisk skleros

Figur 2 - Flödeschema för behandling av hudfibros vid systemisk skleros

Figur 3 - Flödeschema för behandling av artrit vid systemisk skleros
Figur 4 - Flödeschema för behandling av interstitiell lungsjukdom vid systemisk skleros

Förkortningar
ACE– angiotensin converting enzyme
ASCT – autolog stamcellstransplantation
Ca-antagonister – kalciumkanalblockerare
DMARD – disease modifying anti-rheumatic drug
FVC – forcerat vitalkapacitet
GAVE – gastric antral vascular ectasia
HRCT – high resolution computer tomography
H2 – histamin receptor 2
IL – interleukin
ILD – Interstitiell lungsjukdom
IvIG – Intravenösa immunoglobuliner
JAK – Janus kinas
MXT – metotrexat
mRSS – modifierade Rodnan-skin score
MMF – mykofenolat mofetil
NSIP – non-specific interstitial pneumonia
PAH – pulmonell arteriell hypertension
PPI – protonpumphämmare
RCT – randomiserade kontrollerade studier
SSc – systemisk skleros
Scl-70 – scleroderma-70
SSSG – swedish scleroderma study group
Referenser
- Andreasson K, Saxne T, Bergknut C, Hesselstrand R, Englund M. Prevalence and incidence of systemic sclerosis in southern Sweden: population-based data with case ascertainment using the 1980 ARA criteria and the proposed ACR-EULAR classification criteria. Ann Rheum Dis 2014;73 10: 1788-92.
- Morrisroe K, Sudararajan V, Stevens W, Sahhar J, Zochling J, Roddy J et al. Work productivity in systemic sclerosis, its economic burden and association with health-related quality of life. Rheumatology (Oxford) 2018;57 1: 73-83.
- Chevreul K, Brigham KB, Gandre C, Mouthon L, Network B-RR. The economic burden and health-related quality of life associated with systemic sclerosis in France. Scand J Rheumatol 2015;44 3: 238-46.
- Humbert M, Kovacs G, Hoeper MM, Badagliacca R, Berger RMF, Brida M et al. 2022 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension. European heart journal 2022;43 38: 3618-731.
- Del Galdo F, Lescoat A, Conaghan PG, Bertoldo E, Colic J, Santiago T et al. EULAR recommendations for the treatment of systemic sclerosis: 2023 update. Ann Rheum Dis 2024.
- Denton CP, De Lorenzis E, Roblin E, Goldman N, Alcacer-Pitarch B, Blamont E et al. The 2024 British Society for Rheumatology guideline for management of systemic sclerosis. Rheumatology (Oxford) 2024.
- Herrick AL. Raynaud’s phenomenon. Journal of Scleroderma and Related Disorders 2019;4 2: 89-101.
- Fernandez-Codina A, Walker KM, Pope JE, Scleroderma Algorithm G. Treatment Algorithms for Systemic Sclerosis According to Experts. Arthritis & rheumatology 2018;70 11: 1820-8.
- Hachulla E, Agard C, Allanore Y, Avouac J, Bader-Meunier B, Belot A et al. French recommendations for the management of systemic sclerosis. Orphanet J Rare Dis 2021;16 Suppl 2: 322.
- Lebedoff N, Frech TM, Shanmugam VK, Fischer A, Erhardt D, Kolfenbach J et al. Review of local wound management for scleroderma-associated digital ulcers. Journal of Scleroderma and Related Disorders 2018;3 1: 66-70.
- Fujimoto M, Asai J, Asano Y, Ishii T, Iwata Y, Kawakami T et al. Wound, pressure ulcer and burn guidelines – 4: Guidelines for the management of connective tissue disease/vasculitis-associated skin ulcers. J Dermatol 2020;47 10: 1071-109
- Ughi N, Crotti C, Ingegnoli F. Effectiveness and safety of oxycodone/naloxone in the management of chronic pain in patients with systemic sclerosis with recurrent digital ulcers: two case reports. Clin Interv Aging 2016;11: 307-11.
- Braschi F, Bartoli F, Bruni C, Fiori G, Fantauzzo C, Paganelli L et al. Lidocaine controls pain and allows safe wound bed preparation and debridement of digital ulcers in systemic sclerosis: a retrospective study. Clinical rheumatology 2017;36 1: 209-12.
- Hachulla E, Hatron PY, Carpentier P, Agard C, Chatelus E, Jego P et al. Efficacy of sildenafil on ischaemic digital ulcer healing in systemic sclerosis: the placebo-controlled SEDUCE study. Ann Rheum Dis 2016;75 6: 1009-15.
- Temiz Karadag D, Yalcinkaya Y, Akdogan A, Avanoglu A, Bes C, Birlik AM et al. Treatment of systemic sclerosis-associated digital ulcers: recommendations of the Turkish Society for Rheumatology. Clin Exp Rheumatol 2023;41 8: 1679-87.
- Santiago T, Duarte AC, Sepriano A, Castro A, Rosa B, Resende C et al. Portuguese Recommendations for the management of Raynaud’s phenomenon and digital ulcers in systemic sclerosis and other connective tissue diseases. ARP Rheumatol 2024;3 2: 84-94.
- Kayser C, de Oliveira Delgado SM, Zimmermann AF, Horimoto AMC, Del Rio APT, de Souza Muller C et al. 2023 Brazilian Society of Rheumatology guidelines for the treatment of systemic sclerosis. Adv Rheumatol 2024;64 1: 52.
- Ross L, Maltez N, Hughes M, Schoones JW, Baron M, Chung L et al. Systemic pharmacological treatment of digital ulcers in systemic sclerosis: a systematic literature review. Rheumatology (Oxford) 2023;62 12: 3785-800
- Campochiaro C, Suliman YA, Hughes M, Schoones JW, Giuggioli D, Moinzadeh P et al. Non-surgical local treatments of digital ulcers in systemic sclerosis: a systematic literature review. Semin Arthritis Rheum 2023;63: 152267.
- policy: Cc. sildenafil and bosentan for the treatment of digital ulceratioon in systemic sclerosis in adults: nHS England 210302P [1911] first publisched:may 2021 version number:1.0. https://www.england.nhs.uk/wp-content/uploads/2022/01/clinical-commissioning-policy-sildenafil-bosentan-treatment-of-digitalulceration-in-systemic-sclerosis.pdf.
- Ross L, Hansen D, Maltez N, Morrisroe K, Kumar K, Walker J et al. The effect of calcium channel blockers on digital ulcers in systemic sclerosis: data from a prospective cohort study. Clinical rheumatology 2024;43 1: 269-76.
- Fries R, Shariat K, von Wilmowsky H, Bohm M. Sildenafil in the treatment of Raynaud’s phenomenon resistant to vasodilatory therapy. Circulation 2005;112 19: 2980-5.
- Herrick AL, van den Hoogen F, Gabrielli A, Tamimi N, Reid C, O’Connell D et al. Modified-release sildenafil reduces Raynaud’s phenomenon attack frequency in limited cutaneous systemic sclerosis. Arthritis Rheum 2011;63 3: 775-82.
- Shenoy PD, Kumar S, Jha LK, Choudhary SK, Singh U, Misra R et al. Efficacy of tadalafil in secondary Raynaud’s phenomenon resistant to vasodilator therapy: a double-blind randomized cross-over trial. Rheumatology (Oxford) 2010;49 12: 2420-8.
- Tingey T, Shu J, Smuczek J, Pope J. Meta-analysis of healing and prevention of digital ulcers in systemic sclerosis. Arthritis care & research 2013;65 9: 1460-71.
- Wigley FM, Wise RA, Seibold JR, McCloskey DA, Kujala G, Medsger TA, Jr. et al. Intravenous iloprost infusion in patients with Raynaud phenomenon secondary to systemic sclerosis. A multicenter, placebo-controlled, double-blind study. Ann Intern Med 1994;120 3: 199-206.
- Steen V, Denton CP, Pope JE, Matucci-Cerinic M. Digital ulcers: overt vascular disease in systemic sclerosis. Rheumatology (Oxford) 2009;48 Suppl 3: iii19-24.
- Pope J, Fenlon D, Thompson A, Shea B, Furst D, Wells G et al. Iloprost and cisaprost for Raynaud’s phenomenon in progressive systemic sclerosis. Cochrane Database Syst Rev 2000;1998 2: CD000953.
- Riccieri V, Pellegrino G, Cipolletta E, Giuggioli D, Bajocchi G, Bellando-Randone S et al. Practice pattern for the use of intravenous iloprost for the treatment of peripheral vasculopathy in systemic sclerosis: A case-control study from the Italian national multicenter ”SPRING” (Systemic Sclerosis Progression InvestiGation) Registry. J Scleroderma Relat Disord 2024;9 1: 38-49.
- Jamart C, Levesque H, Thietart S, Fain O, Riviere S, Benhamou Y et al. Iloprost Duration for Digital Ulcers in Systemic Sclerosis: French Retrospective Study at Two Centers and Literature Review. Front Med (Lausanne) 2022;9: 878970.
- Blagojevic J, Abignano G, Avouac J, Cometi L, Frerix M, Bellando-Randone S et al. Use of vasoactive/vasodilating drugs for systemic sclerosis (SSc)-related digital ulcers (DUs) in expert tertiary centres: results from the analysis of the observational real-life DeSScipher study. Clinical rheumatology 2020;39 1: 27-36.
- Karalilova RV, Batalov ZA, Sapundzhieva TL, Matucci-Cerinic M, Batalov AZ. Tofacitinib in the treatment of skin and musculoskeletal involvement in patients with systemic sclerosis, evaluated by ultrasound. Rheumatol Int 2021;41 10: 1743-53.
- Hou Z, Su X, Han G, Xue R, Chen Y, Chen Y et al. JAK1/2 Inhibitor Baricitinib Improves Skin Fibrosis and Digital Ulcers in Systemic Sclerosis. Front Med (Lausanne) 2022;9: 859330.
- Korn JH, Mayes M, Matucci Cerinic M, Rainisio M, Pope J, Hachulla E et al. Digital ulcers in systemic sclerosis: prevention by treatment with bosentan, an oral endothelin receptor antagonist. Arthritis Rheum 2004;50 12: 3985-93.
- Matucci-Cerinic M, Denton CP, Furst DE, Mayes MD, Hsu VM, Carpentier P et al. Bosentan treatment of digital ulcers related to systemic sclerosis: results from the RAPIDS-2 randomised, double-blind, placebo-controlled trial. Ann Rheum Dis 2011;70 1: 32-8.
- Shand L, Lunt M, Nihtyanova S, Hoseini M, Silman A, Black CM et al. Relationship between change in skin score and disease outcome in diffuse cutaneous systemic sclerosis: application of a latent linear trajectory model. Arthritis Rheum 2007;56 7: 2422-31.
- van den Hoogen FH, Boerbooms AM, Swaak AJ, Rasker JJ, van Lier HJ, van de Putte LB. Comparison of methotrexate with placebo in the treatment of systemic sclerosis: a 24 week randomized double-blind trial, followed by a 24 week observational trial. Br J Rheumatol 1996;35 4: 364-72.
- Nihtyanova SI, Brough GM, Black CM, Denton CP. Mycophenolate mofetil in diffuse cutaneous systemic sclerosis–a retrospective analysis. Rheumatology (Oxford) 2007;46 3: 442-5.
- Le EN, Wigley FM, Shah AA, Boin F, Hummers LK. Long-term experience of mycophenolate mofetil for treatment of diffuse cutaneous systemic sclerosis. Ann Rheum Dis 2011;70 6: 1104-7.
- Namas R, Tashkin DP, Furst DE, Wilhalme H, Tseng CH, Roth MD et al. Efficacy of Mycophenolate Mofetil and Oral Cyclophosphamide on Skin Thickness: Post Hoc Analyses From Two Randomized Placebo-Controlled Trials. Arthritis care & research 2018;70 3: 439-44.
- Tashkin DP, Roth MD, Clements PJ, Furst DE, Khanna D, Kleerup EC et al. Mycophenolate mofetil versus oral cyclophosphamide in scleroderma-related interstitial lung disease (SLS II): a randomised controlled, double-blind, parallel group trial. Lancet Respir Med 2016;4 9: 708-19.
- Herrick AL, Pan X, Peytrignet S, Lunt M, Hesselstrand R, Mouthon L et al. Treatment outcome in early diffuse cutaneous systemic sclerosis: the European Scleroderma Observational Study (ESOS). Ann Rheum Dis 2017;76 7: 1207-18.
- Steen VD, Medsger TA. Changes in causes of death in systemic sclerosis, 1972-2002. Ann Rheum Dis 2007;66 7: 940-4.
- Rubio-Rivas M, Royo C, Simeon CP, Corbella X, Fonollosa V. Mortality and survival in systemic sclerosis: systematic review and meta-analysis. Semin Arthritis Rheum 2014;44 2: 208-19.
- Mendoza FA, Lee-Ching C, Jimenez SA. Recurrence of progressive skin involvement following discontinuation or dose reduction of Mycophenolate Mofetil treatment in patients with diffuse Systemic Sclerosis. Semin Arthritis Rheum 2020;50 1: 135-9.
- Scheja A, Hesselstrand R, Wildt M, Akesson A. Relapse of skin thickening after discontinuation or decrease of azathioprine therapy in a patient with diffuse cutaneous systemic sclerosis. Rheumatology (Oxford) 2007;46 12: 1862-3.
- Ebata S, Yoshizaki A, Oba K, Kashiwabara K, Ueda K, Uemura Y et al. Safety and efficacy of rituximab in systemic sclerosis (DESIRES): a double-blind, investigator-initiated, randomised, placebo-controlled trial. Lancet Rheumatol 2021;3 7: E489-E97.
- Ebata S, Yoshizaki A, Oba K, Kashiwabara K, Ueda K, Uemura Y et al. Safety and efficacy of rituximab in systemic sclerosis (DESIRES): open-label extension of a double-blind, investigators-initiated, randomised, placebo-controlled trial. Lancet Rheumatol 2022;4 8: e546-e55.
- Jordan S, Distler JH, Maurer B, Huscher D, van Laar JM, Allanore Y et al. Effects and safety of rituximab in systemic sclerosis: an analysis from the European Scleroderma Trial and Research (EUSTAR) group. Ann Rheum Dis 2015;74 6: 1188-94.
- Elhai M, Boubaya M, Distler O, Smith V, Matucci-Cerinic M, Alegre Sancho JJ et al. Outcomes of patients with systemic sclerosis treated with rituximab in contemporary practice: a prospective cohort study. Ann Rheum Dis 2019;78 7: 979-87.
- Daoussis D, Melissaropoulos K, Sakellaropoulos G, Antonopoulos I, Markatseli TE, Simopoulou T et al. A multicenter, open-label, comparative study of B-cell depletion therapy with Rituximab for systemic sclerosis-associated interstitial lung disease. Semin Arthritis Rheum 2017;46 5: 625-31.
- Sullivan KM, Goldmuntz EA, Keyes-Elstein L, McSweeney PA, Pinckney A, Welch B et al. Myeloablative Autologous Stem-Cell Transplantation for Severe Scleroderma. N Engl J Med 2018;378 1: 35-47.
- van Laar JM, Farge D, Sont JK, Naraghi K, Marjanovic Z, Larghero J et al. Autologous hematopoietic stem cell transplantation vs intravenous pulse cyclophosphamide in diffuse cutaneous systemic sclerosis: a randomized clinical trial. Jama 2014;311 24: 2490-8.
- Sullivan KM, Majhail NS, Bredeson C, Carpenter PA, Chatterjee S, Crofford LJ et al. Systemic Sclerosis as an Indication for Autologous Hematopoietic Cell Transplantation: Position Statement from the American Society for Blood and Marrow Transplantation. Biol Blood Marrow Transplant 2018;24 10: 1961-4.
- Eyraud A, Scouppe L, Barnetche T, Forcade E, Lazaro E, Duffau P et al. Efficacy and safety of autologous haematopoietic stem cell transplantation in systemic sclerosis: a systematic review of the literature. Br J Dermatol 2018;178 3: 650-8.
- Agostini E, De Luca G, Bruni C, Bartoli F, Tofani L, Campochiaro C et al. Intravenous immunoglobulins reduce skin thickness in systemic sclerosis: evidence from Systematic Literature Review and from real life experience. Autoimmun Rev 2021;20 12: 102981.
- Koczanowski S, Morrisroe K, Fairley J, Nikpour M, Oon S, Brown Z. Role of intravenous immunoglobulins in systemic sclerosis (SSc): A systematic literature review. Semin Arthritis Rheum 2024;68: 152471.
- Garrote-Corral S, Botello Corzo D, Loarce-Martos J, de la Puente Bujidos C, Carmona L. Efficacy and safety of intravenous immunoglobulin therapy in systemic sclerosis: a systematic review. Rheumatol Int 2024;44 11: 2357-70.
- Moriana C, Moulinet T, Jaussaud R, Decker P. JAK inhibitors and systemic sclerosis: A systematic review of the literature. Autoimmun Rev 2022;21 10: 103168.
- Kayser C, Victoria de Oliveira Martins L. Treatment of Inflammatory Arthritis in Systemic Sclerosis. Rheum Dis Clin North Am 2023;49 2: 337-43.
- Sebastiani M, Giuggioli D, Vesprini E, Caruso A, Ferri C. Successful treatment with leflunomide of arthritis in systemic sclerosis patients. Rheumatology (Oxford) 2006;45 9: 1175-6.
- Elhai M, Meunier M, Matucci-Cerinic M, Maurer B, Riemekasten G, Leturcq T et al. Outcomes of patients with systemic sclerosis-associated polyarthritis and myopathy treated with tocilizumab or abatacept: a EUSTAR observational study. Ann Rheum Dis 2013;72 7: 1217-20.
- Fernandes das Neves M, Oliveira S, Amaral MC, Delgado Alves J. Treatment of systemic sclerosis with tocilizumab. Rheumatology (Oxford) 2015;54 2: 371-2.
- Zacay G, Levy Y. Outcomes of patients with systemic sclerosis treated with tocilizumab: Case series and review of the literature. Best Pract Res Clin Rheumatol 2018;32 4: 563-71.
- Khanna D, Spino C, Johnson S, Chung L, Whitfield ML, Denton CP et al. Abatacept in Early Diffuse Cutaneous Systemic Sclerosis: Results of a Phase II Investigator-Initiated, Multicenter, Double-Blind, Randomized, Placebo-Controlled Trial. Arthritis & rheumatology 2020;72 1: 125-36.
- Giuggioli D, Lumetti F, Colaci M, Fallahi P, Antonelli A, Ferri C. Rituximab in the treatment of patients with systemic sclerosis. Our experience and review of the literature. Autoimmun Rev 2015;14 11: 1072-8.68. Nacci F, Righi A, Conforti ML, Miniati I, Fiori G, Martinovic D et al. Intravenous immunoglobulins improve the function and ameliorate joint involvement in systemic sclerosis: a pilot study. Ann Rheum Dis 2007;66 7: 977-9.
- Komai T, Shoda H, Hanata N, Fujio K. Tofacitinib rapidly ameliorated polyarthropathy in a patient with systemic sclerosis. Scand J Rheumatol 2018;47 6: 505-6.
- Nacci F, Righi A, Conforti ML, Miniati I, Fiori G, Martinovic D et al. Intravenous immunoglobulins improve the function and ameliorate joint involvement in systemic sclerosis: a pilot study. Ann Rheum Dis 2007;66 7: 977-9.
- Hoffmann-Vold AM, Molberg O. Detection, screening, and classification of interstitial lung disease in patients with systemic sclerosis. Curr Opin Rheumatol 2020;32 6: 497-504.
- Hoyles RK, Ellis RW, Wellsbury J, Lees B, Newlands P, Goh NS et al. A multicenter, prospective, randomized, double-blind, placebo-controlled trial of corticosteroids and intravenous cyclophosphamide followed by oral azathioprine for the treatment of pulmonary fibrosis in scleroderma. Arthritis Rheum 2006;54 12: 3962-70.
- Tashkin DP, Roth MD, Clements PJ, Furst DE, Khanna D, Kleerup EC et al. Mycophenolate mofetil versus oral cyclophosphamide in scleroderma-related interstitial lung disease (SLS II): a randomised controlled, double-blind, parallel group trial. Lancet Resp Med 2016;4 9: 708-19.
- Owen C, Ngian GS, Elford K, Moore O, Stevens W, Nikpour M et al. Mycophenolate mofetil is an effective and safe option for the management of systemic sclerosis-associated interstitial lung disease: results from the Australian Scleroderma Cohort Study. Clin Exp Rheumatol 2016;34 Suppl 100 5: 170-6.
- Fischer A, Brown KK, Du Bois RM, Frankel SK, Cosgrove GP, Fernandez-Perez ER et al. Mycophenolate mofetil improves lung function in connective tissue disease-associated interstitial lung disease. J Rheumatol 2013;40 5: 640-6.
- Hoffmann-Vold AM, Maher TM, Philpot EE, Ashrafzadeh A, Barake R, Barsotti S et al. The identification and management of interstitial lung disease in systemic sclerosis: evidence-based European consensus statements. Lancet Rheumatol 2020;2 2: E71-E83.
- Clements PJ, Roth MD, Elashoff R, Tashkin DP, Goldin J, Silver RM et al. Scleroderma lung study (SLS): differences in the presentation and course of patients with limited versus diffuse systemic sclerosis. Ann Rheum Dis 2007;66 12: 1641-7
- Tashkin DP, Elashoff R, Clements PJ, Roth MD, Furst DE, Silver RM et al. Effects of 1-year treatment with cyclophosphamide on outcomes at 2 years in scleroderma lung disease. Am J Respir Crit Care Med 2007;176 10: 1026-34.
- Keir GJ, Maher TM, Hansell DM, Denton CP, Ong VH, Singh S et al. Severe interstitial lung disease in connective tissue disease: rituximab as rescue therapy. Eur Respir J 2012;40 3: 641-8.
- Sircar G, Goswami RP, Sircar D, Ghosh A, Ghosh P. Intravenous cyclophosphamide vs rituximab for the treatment of early diffuse scleroderma lung disease: open label, randomized, controlled trial. Rheumatology (Oxford) 2018;57 12: 2106-13.
- Maher TM, Tudor VA, Saunders P, Gibbons MA, Fletcher SV, Denton CP et al. Rituximab versus intravenous cyclophosphamide in patients with connective tissue disease-associated interstitial lung disease in the UK (RECITAL): a double-blind, double-dummy, randomised, controlled, phase 2b trial. Lancet Respir Med 2022.
- Bellan M, Patrucco F, Barone-Adesi F, Gavelli F, Castello LM, Nerviani A et al. Targeting CD20 in the treatment of interstitial lung diseases related to connective tissue diseases: A systematic review. Autoimmun Rev 2020;19 2: 102453.
- Borrirukwisitsak S, Tantayakom P, Katchamart W. Efficacy and safety of rituximab on lung and skin involvement in systemic sclerosis: a systematic review and metaanalysis. Clinical rheumatology 2021;40 7: 2779-89
- Goswami RP, Ray A, Chatterjee M, Mukherjee A, Sircar G, Ghosh P. Rituximab in the treatment of systemic sclerosis-related interstitial lung disease: a systematic review and meta-analysis. Rheumatology (Oxford) 2021;60 2: 557-67.
- Mankikian J, Caille A, Reynaud-Gaubert M, Agier MS, Bermudez J, Bonniaud P et al. Rituximab and mycophenolate mofetil combination in patients with interstitial lung disease (EVER-ILD): a double-blind, randomised, placebo-controlled trial. Eur Respir J 2023;61 6.
- Keret S, Henig I, Zuckerman T, Kaly L, Shouval A, Awisat A et al. Outcomes in progressive systemic sclerosis treated with autologous hematopoietic stem cell transplantation compared with combination therapy. Rheumatology (Oxford) 2023.
- Distler O, Gahlemann M, Maher TM. Nintedanib for Systemic Sclerosis-Associated Interstitial Lung Disease. Reply. N Engl J Med 2019;381 16: 1596-7.
- Wells AU, Flaherty KR, Brown KK, Inoue Y, Devaraj A, Richeldi L et al. Nintedanib in patients with progressive fibrosing interstitial lung diseases-subgroup analyses by interstitial lung disease diagnosis in the INBUILD trial: a randomised, double-blind, placebo-controlled, parallel-group trial. Lancet Resp Med 2020;8 5: 453-60.
- Andreasson K, Wuttge DM, Wollheim FA. Nintedanib for Systemic Sclerosis-Associated Interstitial Lung Disease. N Engl J Med 2019;381 16: 1595-6.
- Seibold JR, Maher TM, Highland KB, Assassi S, Azuma A, Hummers LK et al. Safety and tolerability of nintedanib in patients with systemic sclerosis-associated interstitial lung disease: data from the SENSCIS trial. Ann Rheum Dis 2020;79 11: 1478-84
- Allanore Y, Vonk MC, Distler O, Azuma A, Mayes MD, Gahlemann M et al. Continued treatment with nintedanib in patients with systemic sclerosis-associated interstitial lung disease: data from SENSCIS-ON. Ann Rheum Dis 2022;81 12: 1722-9.
- Khanna D, Lin CJF, Furst DE, Goldin J, Kim G, Kuwana M et al. Tocilizumab in systemic sclerosis: a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Resp Med 2020;8 10: 963-74.
- Khanna D, Denton CP, Jahreis A, van Laar JM, Frech TM, Anderson ME et al. Safety and efficacy of subcutaneous tocilizumab in adults with systemic sclerosis (faSScinate): a phase 2, randomised, controlled trial. Lancet 2016;387 10038: 2630-40.
- Khanna D, Denton CP, Lin CJF, van Laar JM, Frech TM, Anderson ME et al. Safety and efficacy of subcutaneous tocilizumab in systemic sclerosis: results from the open-label period of a phase II randomised controlled trial (faSScinate). Annals of the Rheumatic Diseases 2018;77 2: 212-20.
- Kuster S, Jordan S, Elhai M, Held U, Steigmiller K, Bruni C et al. Effectiveness and safety of tocilizumab in patients with systemic sclerosis: a propensity score matched controlled observational study of the EUSTAR cohort. RMD Open 2022;8 2.
- Fiorentini E, Bonomi F, Peretti S, Orlandi M, Lepri G, Matucci Cerinic M et al. Potential Role of JAK Inhibitors in the Treatment of Systemic Sclerosis-Associated Interstitial Lung Disease: A Narrative Review from Pathogenesis to Real-Life Data. Life (Basel) 2022;12 12.
- Junfei Z, Meihua G, Shuai Z, Xiangting L, Zhidan L, Tianming C et al. Retrospective comparative study of the efficacy of JAK inhibitor (tofacitinib) in the treatment of systemic sclerosis-associated interstitial lung disease. Clinical rheumatology 2023;42 10: 2823-32.
- Chan EY, Goodarzi A, Sinha N, Nguyen DT, Youssef JG, Suarez EE et al. Long-Term Survival in Bilateral Lung Transplantation for Scleroderma-Related Lung Disease. Ann Thorac Surg 2018;105 3: 893-900.
- Jablonski R, Dematte J, Bhorade S. Lung transplantation in scleroderma: recent advances and lessons. Curr Opin Rheumatol 2018;30 6: 562-9.
- Pradere P, Tudorache I, Magnusson J, Savale L, Brugiere O, Douvry B et al. Lung transplantation for scleroderma lung disease: An international, multicenter, observational cohort study. J Heart Lung Transplant 2018;37 7: 903-11.
- Woodworth TG, Suliman YA, Li W, Furst DE, Clements P. Scleroderma renal crisis and renal involvement in systemic sclerosis. Nat Rev Nephrol 2016;12 11: 678-91.
- Steen VD, Medsger TA, Jr., Osial TA, Jr., Ziegler GL, Shapiro AP, Rodnan GP. Factors predicting development of renal involvement in progressive systemic sclerosis. Am J Med 1984;76 5: 779-86.
- Zanatta E, Polito P, Favaro M, Larosa M, Marson P, Cozzi F et al. Therapy of scleroderma renal crisis: State of the art. Autoimmun Rev 2018;17 9: 882-9.
- Butikofer L, Varisco PA, Distler O, Kowal-Bielecka O, Allanore Y, Riemekasten G et al. ACE inhibitors in SSc patients display a risk factor for scleroderma renal crisis-a EUSTAR analysis. Arthritis Res Ther 2020;22 1: 59.
- Cozzi F, Marson P, Cardarelli S, Favaro M, Tison T, Tonello M et al. Prognosis of scleroderma renal crisis: a long-term observational study. Nephrol Dial Transplant 2012;27 12: 4398-403.
- Schwartz J, Padmanabhan A, Aqui N, Balogun RA, Connelly-Smith L, Delaney M et al. Guidelines on the Use of Therapeutic Apheresis in Clinical Practice-Evidence-Based Approach from the Writing Committee of the American Society for Apheresis: The Seventh Special Issue. J Clin Apher 2016;31 3: 149-62.
- Gouin A, Ribes D, Colombat M, Chauveau D, Prevot G, Lairez O et al. Role of C5 inhibition in Idiopathic Inflammatory Myopathies and Scleroderma Renal Crisis-Induced Thrombotic Microangiopathies. Kidney Int Rep 2021;6 4: 1015-21.
- Farrukh L, Steen VD, Shapiro L, Mehta S. Studying the Role of C5-Inhibition Therapy in Scleroderma Renal Crisis-Induced Thrombotic Microangiopathy – A Review of Literature. Semin Arthritis Rheum 2023;63: 152256.
- Kaniecki T, Abdi T, McMahan ZH. A practical approach to the evaluation and management of gastrointestinal symptoms in patients with systemic sclerosis. Best Pract Res Clin Rheumatol 2021: 101666.
- Muro Y, Sugiura K, Nitta Y, Mitsuma T, Hoshino K, Usuda T et al. Scoring of reflux symptoms associated with scleroderma and the usefulness of rabeprazole. Clin Exp Rheumatol 2009;27 3 Suppl 54: 15-21.
- Yadlapati R, Gyawali CP, Pandolfino JE, Participants CGCC. AGA Clinical Practice Update on the Personalized Approach to the Evaluation and Management of GERD: Expert Review. Clin Gastroenterol Hepatol 2022;20 5: 984-94 e1.
- Fiorucci S, Distrutti E, Bassotti G, Gerli R, Chiucchiu S, Betti C et al. Effect of erythromycin administration on upper gastrointestinal motility in scleroderma patients. Scand J Gastroenterol 1994;29 9: 807-13.
- Dein EJ, Wigley FM, McMahan ZH. Linaclotide for the treatment of refractory lower bowel manifestations of systemic sclerosis. BMC Gastroenterol 2021;21 1: 174.
- Vigone B, Caronni M, Severino A, Bellocchi C, Baldassarri AR, Fraquelli M et al. Preliminary safety and efficacy profile of prucalopride in the treatment of systemic sclerosis (SSc)-related intestinal involvement: results from the open label cross-over PROGASS study. Arthritis Res Ther 2017;19 1: 145.
- Nikou GC, Toumpanakis C, Katsiari C, Charalambopoulos D, Sfikakis PP. Treatment of small intestinal disease in systemic sclerosis with octreotide: a prospective study in seven patients. J Clin Rheumatol 2007;13 3: 119-23.
- Soudah HC, Hasler WL, Owyang C. Effect of octreotide on intestinal motility and bacterial overgrowth in scleroderma. N Engl J Med 1991;325 21: 1461-7.
- Parodi A, Sessarego M, Greco A, Bazzica M, Filaci G, Setti M et al. Small intestinal bacterial overgrowth in patients suffering from scleroderma: clinical effectiveness of its eradication. Am J Gastroenterol 2008;103 5: 1257-62.
- Shah A, Pakeerathan V, Jones MP, Kashyap PC, Virgo K, Fairlie T et al. Small Intestinal Bacterial Overgrowth Complicating Gastrointestinal Manifestations of Systemic Sclerosis: A Systematic Review and Meta-analysis. J Neurogastroenterol Motil 2023;29 2: 132-44.
- Tandaipan J, Guillen-Del-Castillo A, Simeon-Aznar CP, Carreira PE, De la Puente C, Narvaez J et al. Immunoglobulins in systemic sclerosis management. A large multicenter experience. Autoimmun Rev 2023;22 11: 103441.
- Matsumoto Y, Hayashi H, Tahara K, Yasuda T, Tsubouchi S, Yamamoto Y et al. Intravenous Cyclophosphamide for Gastric Antral Vascular Ectasia Associated with Systemic Sclerosis Refractory to Endoscopic Treatment: A Case Report and Review of the Pertinent Literature. Internal medicine 2019;58 1: 135-9.
- Lescoat A, Zimmermann F, Murray CD, Khanna D, Hughes M, McMahan ZH. Systemic sclerosis-related fecal incontinence: a scoping review focusing on a neglected manifestation. Rheumatology (Oxford) 2024.

